Eso es exactamente lo que es un compuesto binario o también llamada sustancia binaria, 2 elementos diferentes.
"Un compuesto binario es un compuesto químico que tiene únicamente 2 elementos químicos diferentes". Es decir, es un compuesto que tendrá atomos solo de dos elementos.
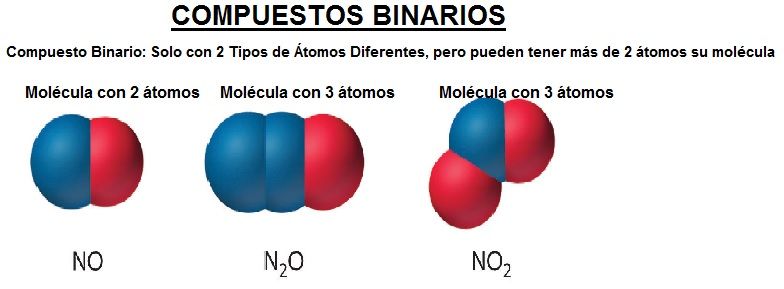
OJO esto no signifíca que la molécula tenga solo 2 átomos, significa que la molécula podrá estar formada por el número de átomos que quiera, pero con 2 tipos de átomos diferentes. Por ejemplo, el agua es un compuesto quimico formado por átomos de hidrógeno y átomos de oxígeno, por lo que será un compuesto binario, pero su molécula está formada por 3 átomos.
Recuerda:
- Un elemento químico es un tipo de sustancia que no puede ser separada en sustancias más simples por métodos químicos. La tabla periódica de los elementos agrupa todos los elementos químicos que existen, por ejemplo el hierro, el oxígeno, el carbono, etc. Cada uno de ellos es un elemento.
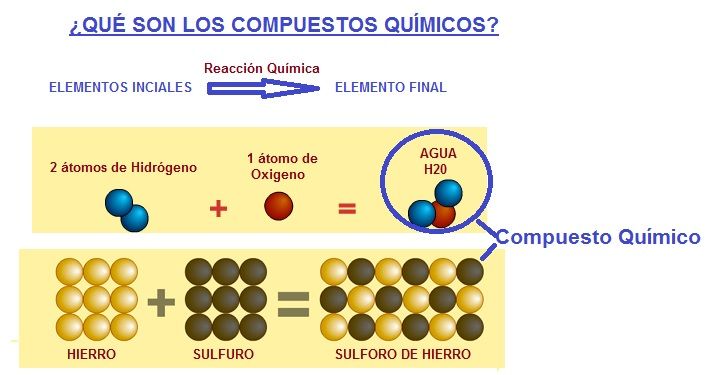
- Los Compuesto Químicos son sustancias que están formadas por un mínimo de 2 elementos que han reaccionado entre si para dar otra sustancia diferente a los elementos iniciales. La sustancia producto de la reacción es el compuesto químico.
Pues bien, cuando tenemos varios elementos iniciales (mínimo 2) que reaccionan entre sí, cuyo producto de la reacción es un compuesto formado solo por dos tipos de átomos diferentes, este compuesto formado es lo que se llama un Compuesto Binario o Sustancia Binaria.
El ejemplo más conocido es el agua.
¿Sabrias decir como se llamaría un compuesto formado por 3 átomos diferentes? ¿Y por 4?. Pues sencillo Ternarios y Cuaternarios. En otra página los veremos, aqui nos centraremos en los binarios.
Ya sabemos los que son los compuesto binarias, ahora veamos como se clasifican.
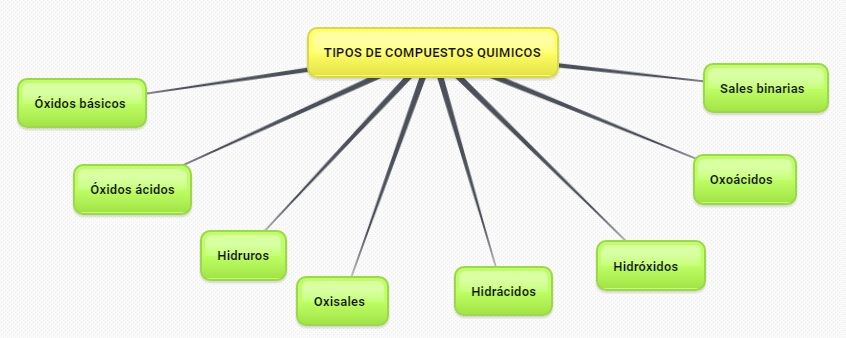
Tipos de Compuestos Binarios
Como solo tienen dos átomos diferentes, la clasificación se puede hacer fácilmente en función de cómo sea cada uno de los átomos.
- Si está formado por un átomos de un Metal + No Metal; se llaman Sales Binarias.
- Si está formado por átomos de un No Metal + No metal; se llaman Sales Volatiles.
- Si está formado por átomos de Oxígeno + Cualquier otro elemento; se llaman Óxidos.
- Si está formado por átomos del Anión Hidróxido (OH) + Metal; se llaman Hidróxidos. Aunque realmente están formados por tres elementos distintos, los hidróxidos se comportan como compuestos binarios, ya que el ión negativo o anión hidróxido (OH) actúa siempre como una unidad conjunta, como si fuera un único átomo.
Esta clasificación es muy importante, sobre todo a la hora de escribir su formula y de como se llama el compuesto. Aqui tienes un tabla que separa los elementos metálicos de lo no metales.
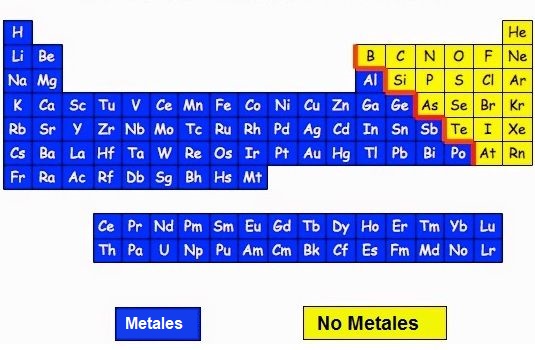
Nombre y Fórmula de los Compuestos Binarios
Vamos aprender como se escribe la fórmula de los diferentes compuestos binarios y como se escribe su nombre en función del tipo al que pertenezcan. Pero primero veamos lo común a todos y que es importante conocer.
Cosas Comúnes a Todos los Tipos
- En todos ellos el número de átomos de cada tipo se indican con subíndices. Por ejemplo CrBr3, la molécula del compuesto binario tiene 3 atomos de Bromo (Br) y uno de Cromo (Cr).
. Para nombrarlos siempre se empieza por el segundo elemento (el de la derecha) seguido del primero (el de la izquierda), Un ejemplo: CuBr2: Bromuro de Cobre. Cu = cobre, Br = bromo.
- Para nombrar los compuestos binarios se suele utilizar 3 formas diferentes, la tradicional, la sistematica y la de stock. En todos los casos se nombran de derecha a izquierda los elementos. En general:
Tradicional: Se nombra primero el elemento químico de la derecha (como siempre) pero seguido del subfijo "uro". A continuación el primer elemento de la fórmula (el de la izquierda) añadiendo un sufijo relacionado con la valencia, "oso" si se usa la menor e "ico" si se usa la mayor. Si solo tiene una valencia "ico" también (luego veremos las valencias).
Un ejemplo: FeCl3: Cloruro Ferrico. Usamos la valencia mayor del hierro (3). Este tipo cada vez se usa menos.
Sistemática o estequiométrica recomendada por la IUPAC: usando prefijos numéricos (mono = 1, di = 2, tri = 3, tetra= 4 , penta = 5, hexa= 6...) y acabado en "uro" el nombre del elemento que se escribe a la derecha en la fórmula + nombre de elemento que se escribe a la izquierda. Un ejemplo FeCl3: TriCloruro de Hierro.
Stock: indicandoentre paréntesis y con números romanos la valencia. Un ejemplo: CuBr2: Bromuro de Cobre (II)
Luego veremos para cada tipo su uso concreto.
Como ves es muy importante el uso de la valencia. Recordemos brevemente que es eso de la valencia:
La valencia es el número de electrones de la últimacapa (capa de valencia) involucrados en el enlace químico (en la unión) de los dos elementos para formar el compuesto binario.
Es necesario saber qué valencia o valencias tiene un determinado elemento químico dentro del compuesto. Hay elementos que tienen más de una valencia.
Aqui te dejamos la tabla de valencias de los elementos más importantes. Si quieres saber como obtener la valencia: Familias de la Tabla Periodica.
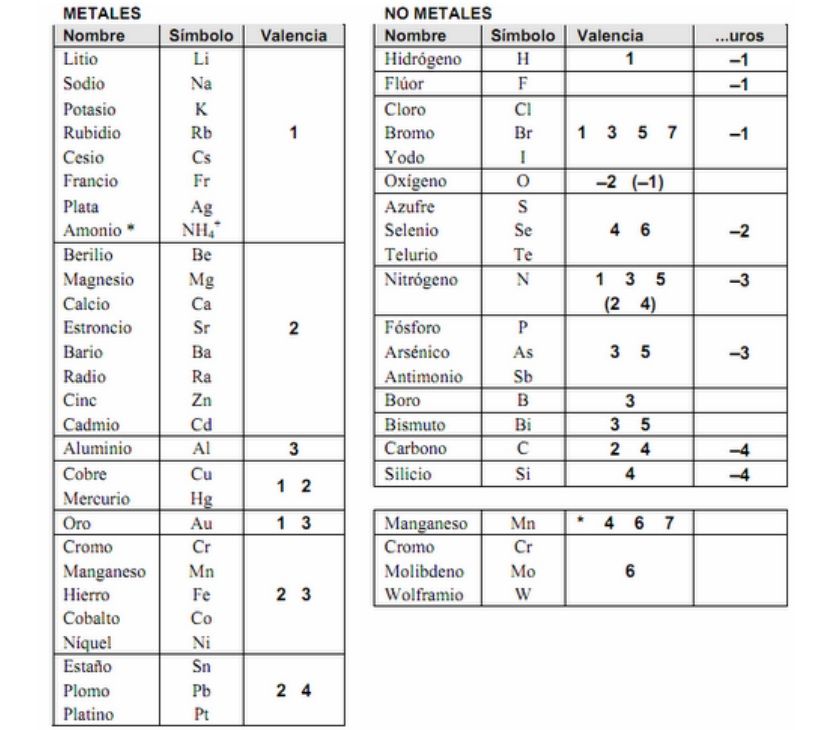
Fíjate que por ejemplo el Cobre (Cu) puede tener dos valencias, 1 o 2.
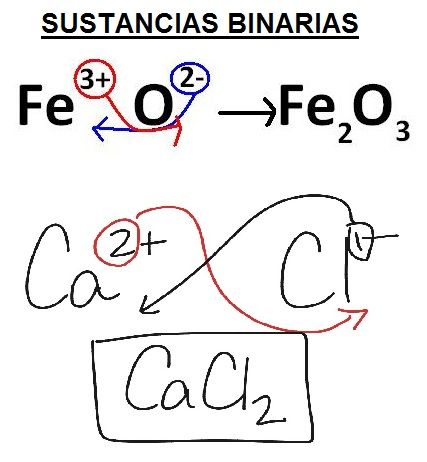
Por ejemplo: En el compuesto CrBr3: El cromo está actuando con valencia 3 (Cr +3 ) y el bromo lo hace con valencia –1 (Br –1 ) (el cromo puede tener valencia 2, 3 y el bromo puede tener valencia +1, –1, 3, 5, 7).
La fórmula sería Cr + 3 Br , intercambiamos las valencias pero poniendo su número como subíndice y queda
CrBr3 (sería Cr 1 , pero el uno no se escribe).
Ahora sí, pasamos a ver como se nombran y se escribe su fórmula. En todos los casos veremos primero la nomenclatura tradicional, después la sistemática y por último la de stock. Al final de la página tienes muchos ejemplos.
Formulación de Cada Tipo
Metal + No Metal = Sales Binarias
En estos compuestos, el símbolo del metal se escribe en primer lugar y, a continuación, el símbolo del no metal.
En Tradicional: Se nombra primero el nombre del no metal, seguido de la palabra "uro". A continuación se coloca el nombre del metal terminado en ico. Si el metal tiene dos valencias se emplea la terminación "oso" si se usa la menor e "ico" si se usa la mayor. Ejemplos:
NiF2: fluoruro niqueloso. Usamos la valencia menos del Niquel (2). Fíjate en la tabla de valencias de arriba.
NiF3: fluoruro niquélico. Usamos la valencia mayor del Niquel. Fijate en la tabla de valencias.
CaBr2: Bromuro Calcico. el calcio solo tiene valencia 2. Fíjate en la tabla.
FeCl3: Cloruro Ferrico. Usamos la valencia mayor del hierro (3).
En Sistematica: Se nombra primero el no metal precedido del prefijo que nos dice el número de átomos que tiene (mono = 1, di = 2, tri = 3, etc) y terminado en "uro", a continuación el nombre del metal.
Ejemplos:
FeCl3: TriCloruro de Hierro
CaBr2: DiBromuro de Calcio.
Au2S3: Trisulfuro de Dioro.
En las sales binarias, el No metal siempre utiliza su menor valencia.
En Stock: Se nombra primero el nombre del no metal terminado en "uro" y después la preposición "de" y por último el nombre del metal, indicando el número su valencia en números romanos y entre parentesis. Esta es la más usada de todas hoy en día. Resumiendo: Nombre del No Metal + de + Nombre del Metal (suValencia)
FeCl3: Cloruro de Hierro (III).
CuBr2: Bromuro de Cobre (II).
FeBr3: bromuro de hierro (III).
Como veremos a continuación, estos 3 tipos de nomenclatura se hace más o menos igual para los otros tipos de compuestos binarios.
No Metal + No metal = Sal Volatil
Siempre se escribe el no metal que esté más a la izquierda de la lista siguiente de elementos no metálicos y después el otro No Metal.
B, Si, C, Sb, As, P, N, H, Te, Se, S, Atm I, Br, Cl, O, F.
OJO son no metales distintos del óxido y el hidrogeno, ya que como veremos a continuación estos forman otro tipo de compuesto binario.
No se suele utilizar la Tradicional, pero aqui tienes algunos ejemplos:
B2S3: Sulfuro de boro.
CS: Sulfuro carboso.
CS2: Sulfuro carbónico.
En Sistemática, se nombra primero el elemento que se escribe a la derecha terminado en "uro", con su prefijo y a continuación el nombre del otro elemento. Esta es la más usada.
Ejemplos:
PCl3 : Tricloruro de fósforo
As2S5 :Pentasulfuro de diarsénico.
En Stock Sería:
PCl3 : Cloruro de fósforo (III). 3 (III) es la valencia con la que actúa el No Metal.
As2S5 : Sulfuro de arsénico (V)
Oxidos = Cualquier elemento + Oxígeno
Si el el elemento es un metal, se llaman óxidos metálicos, y óxidos no metálicos si el otro elemento es un no metal. ¿Fácil No?. OJO Todos se llaman Oxido de... Hay una excepción, el agua.
Oxidos Metálicos: Se escribe primero el metal y luego el oxigeno. Cuando el metal tiene más de una valencia, para nombrar a estos óxidos, se agrega al nombre del metal la terminación "oso" o "ico" según sea la valencia menor o mayor en la Nomenclatura Tradicional. Ejemplos:
Na2O óxido de sodio, el metal solo tiene una valencia.
SnO2 óxido estánico, el metal usa la valencia mayor.
Cu2O óxido cuproso, el metal usa la valencia menor.
NiO: óxido niqueloso.
Ni2O3: óxido niquélico.
Veamos ahora la Sistemática:
Na2O: monóxido de disodio
Ni2O3: trióxido de diníquel
En Stock:
Ni2O3: óxido de níquel (III)
HgO: óxido de mercurio (II)
Óxidos No Metálicos: También se llaman anhidridos. Se escriben primero el no metal y luego el óxido.
En Tradicional la palabra anhidrido seguido del no metal con los sufijos "oso" o "ico", ya sabes si usa la menor o mayor valencia del no metal:
CO: anhídrido carbonoso
CO2: anhídrido carbónico
SiO2: anhídrido silícico
En Sistemática: número de átomos de cada elemento seguido de la expresión "óxido" + el elemento no metálico precedido de la valencia del elemento no metálico.
P2O5: pentaóxido de difósforo
Cl2O: monóxido de dicloro
N2O Óxido de dinitrógeno
CO2: Dióxido de carbono
Cl2O7: Heptaóxido de dicloro
En Stock: Se nombran oxido de... seguido del no metal con la valencia que actúa.
CO2: óxido de carbono (IV) (cuatro porque se simplifica).
Br2O3: óxido de bromo (III)
Cl2O , Óxido de cloro (I)
Cl2O3 Óxido de cloro (III)
Cl2O5 Óxido de cloro (V)
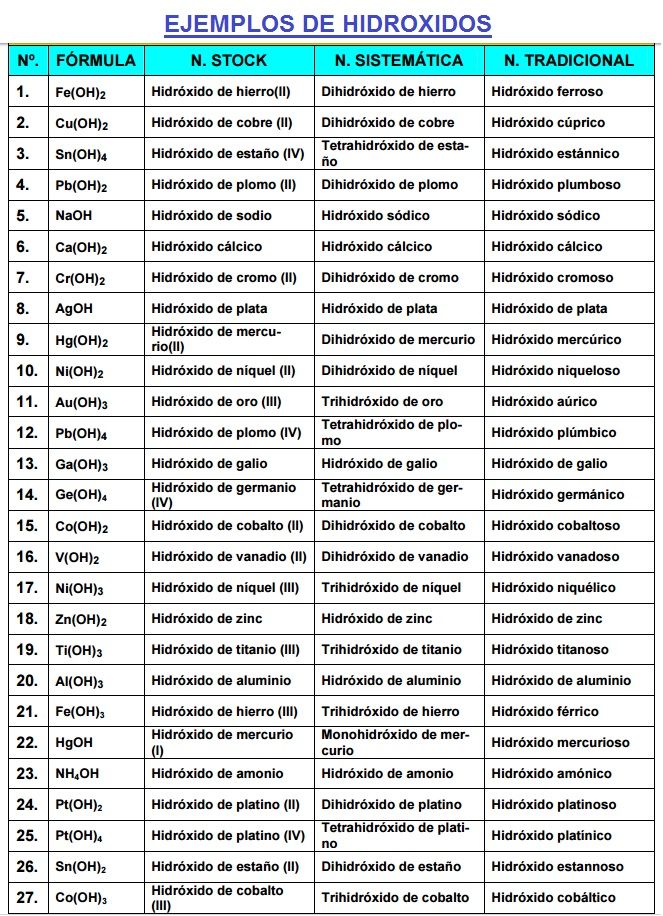
Hidróxidos = Anión Hidróxido (OH) + Metal
Todos se llaman hidróxido de... y se forman con un metal.
Se escribe Metal + (OH). Se nombran hidróxido de... más el nombre del metal.
Tradicional: con "oso" o "ico".
Pt(OH)2: hidróxido platinoso
Pt(OH)4: hidróxido platínico
Sistemática:
Be(OH)2: dihidróxido de berilio
Sn(OH)4: tetrahidróxido de estaño
Be(OH)2: dihidróxido de berilio
Fe(OH)3: trihidróxido de hierro
Fe(OH)3: trihidróxido de hierro
Stock:
HgOH: hidróxido de mercurio (I)
Sn(OH)2: hidróxido de estaño (II)
Veamos ahora más ejemplos.
Compuestos Binarios Ejemplos
Sales Binarias Ejemplos
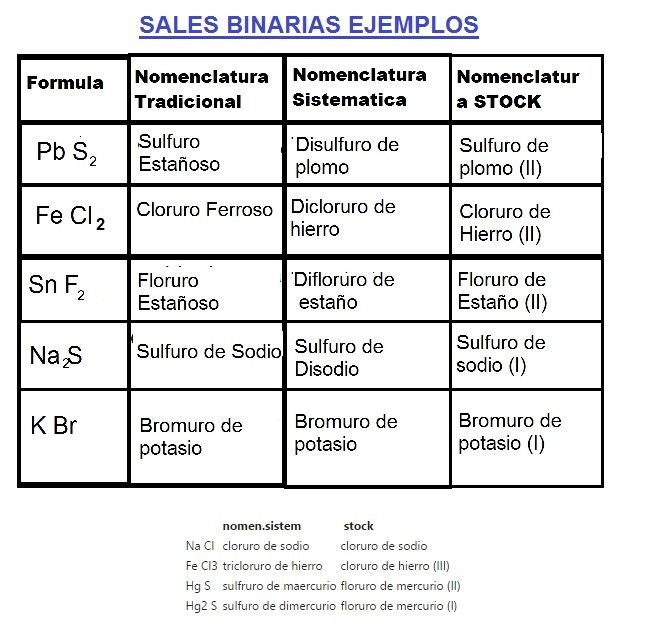
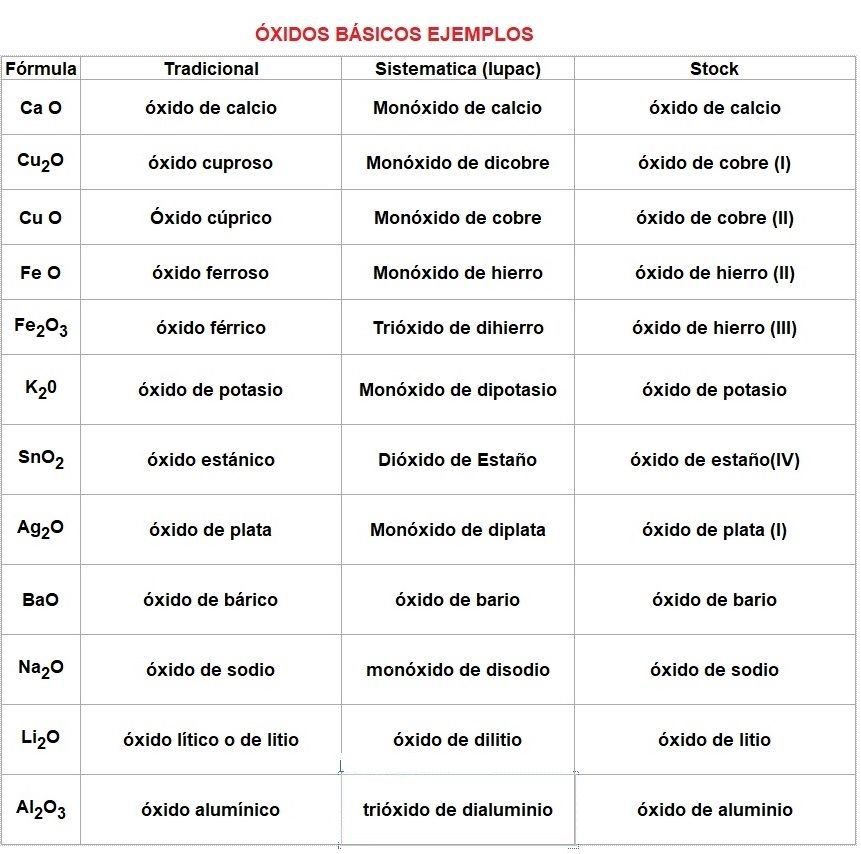
Oxidos Basicos Ejemplos
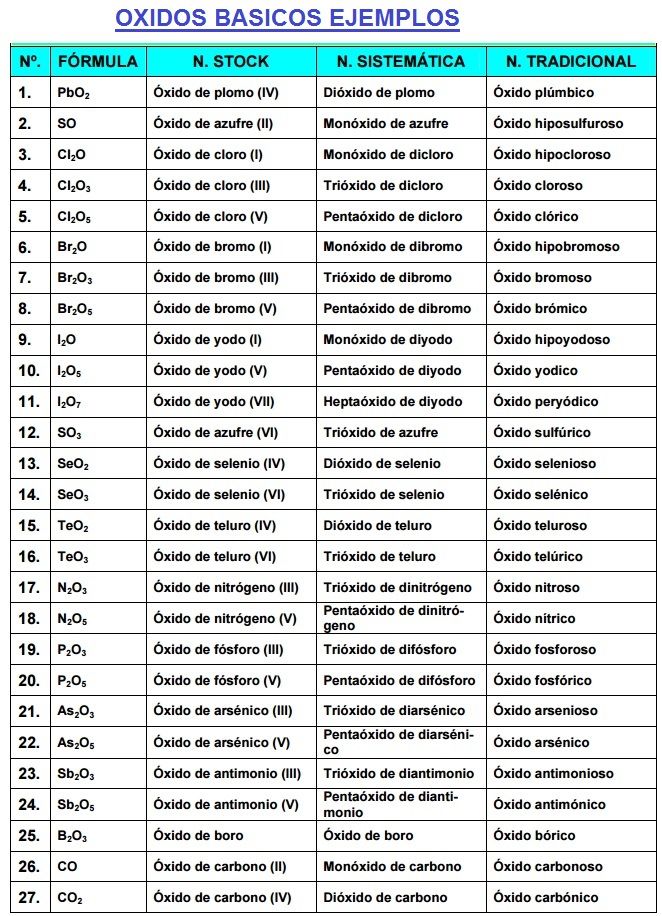
Si quieres más oxidos básicos visita el siguiente enlace: Oxidos Basicos Ejemplos
Ejemplos de Hidróxidos